 www.lagonlon.com
www.lagonlon.com| 2He | : | 2 |
| 10Ne | : | 2 - 8 |
| 18Ar | : | 2 - 8 - 8 |
| 36Kr | : | 2 - 8 - 18 - 8 |
| 54Xe | : | 2 - 8 - 18 - 18 - 8 |
| 86Rn | : | 2 - 8 - 18 - 32 - 18 - 8 |
| 1. | Tentukan bagaimana unsur 4X mencapai kestabilan dengan transfer elektron,
ion yang terbentuk, dan kaidah yang diikuti! Penyelesaian:
| ||||||||||||||||||||||||
| 2. | Tentukan bagaimana unsur 9F mencapai kestabilan dengan transfer elektron,
ion yang terbentuk, dan kaidah yang diikuti! Penyelesaian:
| ||||||||||||||||||||||||
| 3. | Tentukan bagaimana unsur 13Al mencapai kestabilan dengan transfer elektron,
ion yang terbentuk, dan kaidah yang diikuti! Penyelesaian:
| ||||||||||||||||||||||||
| 4. | Tentukan bagaimana unsur 16S mencapai kestabilan dengan transfer elektron,
ion yang terbentuk, dan kaidah yang diikuti! Penyelesaian:
| ||||||||||||||||||||||||
| No. | Golongan | Elektron valensi | Cara mencapai kestabilan | Ion yang terbentuk | Keterangan |
|---|---|---|---|---|---|
| 1. | I A | 1 | melepas 1 elektron | X + | |
| 2. | II A | 2 | melepas 2 elektron | X 2+ | |
| 3. | III A | 3 | melepas 3 elektron | X 3+ | |
| 4. | IV A | 4 | - | - | cenderung berikatan kovalen |
| 5. | V A | 5 | menambah 3 elektron | X 3- | |
| 6. | VI A | 6 | menambah 2 elektron | X 2- | |
| 7. | VII A | 7 | menambah 1 elektron | X - | |
| 8. | VIII A | 8 | - | - | sudah stabil |
Mohon dimaklumi, jika materi dalam tutorial ini dirasa kurang lengkap dan menyeluruh.
Tutorial ini dibuat sebagai fitur bantuan bagi peserta dalam mengerjakan mata kuis di www.lagonlon.com.
Namun demikian, penyajian yang mudah dipahami merupakan tujuan utama kami.
Masukan dari anda, akan sangat membantu kami dalam melakukan perbaikan.
Terimakasih atas kunjungan anda.
Unsur 14 Si dan 17 CI mencari keadaan unsur, cara unsur stabil dan konfigurasi elektron gas mulia?
14Si memiliki konfigurasi elektron:
2 - 8 - 4
Dapat mencapai kestabilan dengan melakukan penggunaan bersama pasangan elektron (ikatan kovalen)
17Cl memiliki konfigurasi elektron:
2 - 8 - 7
dapat mencapai kestabilan dengan menangkap 1 elektron, sehingga konfigurasi elektronnya menjadi:
2 - 8 - 8
Konfigurasi elektron ini sudah stabil karena:
- sudah memenuhi kaidah oktet
- sudah sama dengan konfigurasi elektron Argon yang merupakan unsur golongan gas mulia.
Bagaimana cara atom Na dengan Cl berkaitan agar mencapai kestabilan?
Na dan Cl
 Na+ + e
Na+ + e
 Cl-
Cl-
 NaCl
NaClBagaimana cara atom atom berikut untuk mencapai kestabilan: 12Mg, 15P, dan 25Mn
Buatlah unsur unsur berikut menjadi atom stabil : l, k, mg, sr, Ba, F, o, dan I,
Bagaimana pembentukan senyawa MG°bisa mencapai kesetabilan dengan cara melepas dan menerima elektron 3.Bagaimana pembentukan senyawa CH4 untuk mencapai kesetabilan beradasarkan simbol lewis? Tuliskan kesimpulan dari materi lewis?
Ikatan apa yang terbentuk antara unsur Hidrogen dengan nomor atom 1 dengan unsur oksigen dengan nomor atom 8 ? Jelaskan bagaimana proses terbentuknya ikatan 2 unsur tersebut Tolong yang tahu
Ikatan yang terbentuk adalah ikatan kovalen (polar)
Senyawa yang terbentuk: H2O
Terbentuknya melalui penggunaan bersama pasangan elektron
struktur Lewisnya:

Tuliskan jumlah elektron yang harus di lepas atau di terimah unsur 34 SR agar mencapai keadaan satabil
Unsur 34 Se Nomor Atom = 34 Konfigurasi Elektron = 2-8-18-6 Cara Mencapai Kestabilan = menambah 2 elektron Ion Yang Terbentuk = Se²⁻
Jika ada atom yang masih kekurangan muatan, menurutmu bagaimana cara atom tersebut melengkapi muatannya?
atom yang cenderung bermuatan negatif (non logam), jika bertemu sesamanya (sesama nonlogam), biasanya akan membentuk ikatan kovalen.
Tuliskan proses terbentuknya ikatan 13p dan 35Br
kepo banget sii
Bagaimanakah unsur Kalium (K), Magnesium (Mg), dan Klor(Cl) mencapai kestabilan dan gambarkan struktur nya?
mana saya tahu, saya kan ikan
Mantapp:v
Tuliskan pelepasan elektron valensi nya unsur unsur Na Mg Al
| Na |  | Na+ | + | e |
| Mg |  | Mg2+ | + | 2e |
| Al |  | Al3+ | + | 3e |
Ikatan ion K=19 dengan CI=17
 K+ + e
K+ + e
 Cl-
Cl-
 K2O
K2OBagaimana unsur Br 35 mencapai kestabilan
Brom (Br) menangkap 1 elektron membentuk ion Br-
Konfigurasi elektron awal:
35Br : 2 - 8 - 18 - 7
Konfigurasi elektron akhir:
35Br- : 2 - 8 - 18 - 8
Tentukan rumus senyawa dan jenis ikatan dan unsur berikut ini: A.1h dengan 8o B.6c dengan 8o C.6c dengan 1h
H2O
ikatan kovalen polar
CO
ikatan kovalen polar
CO2
ikatan kovalen nonpolar
CH4
ikatan kovalen nonpolar
3Li menenrima berapa elektron? stabil atau tidak stabil?. 15P melepas berapa elektron? stabil atau tidak stabil?. 35Br melepas dan menerima 1 elektron, apakah stabil atau tidak stabil? Mohon dijawab kak
3Li belum stabil
dapat mencapai kestabilan dengan melepas 1 elektron
15P belum stabil
dapat mencapai kestabilan dengan menangkap 3 elektron
35Br belum stabil
dapat mencapai kestabilan dengan menangkap 1 elektron
20Ca melepas 2 elektron, menerima berapa eektron? stabil atau tidak stabil?. 13Al menerima berapa elektron? stabil atau tidak stabil?. 6C melepas berapa elektron? stabil atau tidak stabil?.
20Ca
Konfigurasi elektron: 2 - 8 - 8 - 2
dapat mencapai kestabilan dengan melepas 2 elektron terakhirnya
ion yang terbentuk: Ca2+
13Al
Konfigurasi elektron: 2 - 8 - 3
dapat mencapai kestabilan dengan melepas 2 elektron terakhirnya
ion yang terbentuk: Al3+
6C
Konfigurasi elektron: 2 - 4
dapat mencapai kestabilan dengan melepas 4 elektron atau menambah 4 elektron
melepas atau menambah?
Unsur dengan elektron valensi 4 cenderung berikatan kovalen (tidak melepas atau menambah elektron)
Jarang berada pada keadaan ion tunggal
Assalamualaikum warahmatullahi wabarakatuh Maaf kok penjelasannya ngak ada yang pas gitu ya yang langsung to the point
Wa alaikum salam.
Maaf
apa hubungannya ikatan kimia dengan kestabilan atom?
Dengan melakukan ikatan kimia, atom-atom akan memiliki kestabilan,
Yaitu memiliki konfigurasi elektron seperti gas mulia.
Ch unsur mencapai kestabilan dengan cara menggunakan elektron bersama
Senyawa yang tersusun dari unsur-unsur non logam biasanya berikatan kovalen (terjadi penggunaan bersama pasangan elektron).
Contohnya:
CH4
CO2
NH3
Dik:atom:A1 jumlah elektron 13 dapat melespakan 3 elektron dan membantu ion Al 3+. Dit:tentukan konfigurasi elektron per sub kukit pada ion Al3+ adalah? Tolong dijawab:)
13Al3+ : 1s2 2s2 2p6
bagaimana unsur Ca , S , dan Br ini agar stabil
Unsur O dengan nomor atom 8 akan mencapai konfigurasi elektron yang stabil dengan cara...
Jika ada yang tau apa jawaban dari soal diatas tolong kasih tau saya plisss
Unsur O dengan nomor atom 8 bisa stabil jika menengkap 2 elektron sehingga menjadi nomor atom 10
Analisislah cara unsur mencapai kestabilan!(sudah ada diatas)Jelaskan pula mengapa unsur2 tersebut membentuk suatu senyawa?
Kalo ada yang bisa plis bantu
ketika ada satu atom yang ingin mencapai kestabilan dengan melepas elektron, maka harus ada atom lain yang mau menerima elektron tersebut.
Dilarang membuang elektron sembarangan!!!
Kerjasama antara atom yang melepas dan atom yang menerima elektron inilah yang akhirnya membentuk senyawa.
Tentukan jumlah elektron yang harus dilepas atau diserap oleh atom-atom dibawah ini untuk mencapai kestabilan nya A.11 na B.17 Cl C.30 Zn
berdasarkan model 3, bagaimana kecenderungan atom Na dan Ci mencapai kestabilan (sesuai aturan octet) apakah melepas atau menerima elektron?
Diantara unsur ¹k, 6L, ¹³m, ¹7N, dan 8O. Unsur yang mempunyai konfirmasi rlektron stabil adalah undur??
Belum ada yang stabil
Berapa elwktronkah yang harus di terima oleh atom oksigen (0) dari unsur lain supaya oksigen tersebut stabil?
2 elektron,supaya mirip gas mulia
Jelaskan bagai mana kecendrungan atom atom berikut ini mencapai kesetabilan jika di tinjau dari dikonfigurasi? ⁶ C ⁹ F ¹⁹ K
Tentukan jumlah elektron yang harus dilepas atau diserap oleh atom-atom dibawah ini untuk mencapai kestabilannya 7N 13Al 14Si
Buatlah ayat jurnal penyesuaian yg di perlukan pada tanggal 30 juni 2015
Bagaimana cara atom Li,Cl,Ca dan O mencapai kestabilan
Jelaskan kestabilan unsur Al dengan nomor atom 13
Konfigurasi elektronnya:
2 - 8 - 3.
karena elektron valensinya = 3, maka Al dapat mencapai kestabilan dengan melepas 3 elektron menjadi ion:
Al3+
Suatu atom Z setelah melepaskan 2 elektron, nomor atomnya menjadi 24. Tuliskan konfigurasi elektron atom tersebut pada keadaan netral dengan menggunakan gas mulia !
Setelah melepaskan 2 elektron, nomor atom tidak berubah.
Karena nomor atom menyatakan jumlah proton (bukan elektron).
Maka jumlah elektron atom dalam keadaan netral = 24.
24X: [Ar] 4s1 3d5
Unsur C ,memiliki jumlah elektron 6 ,maka untuk mencapai kestabilan unsur tersebut harus???
Menambah 2 elektron. Jadi ion yang terbentuk C²-
Tentukan jumlah elektron yang dapat dilepaskan atau diterima unsur unsur untuk mencapai kestabilannya( Perhatikan tabel periodi) 1. Oksigen 2. Natrium 3. Klor 4. Kalium 5. Kalsium
Oksigen, merupakan unsur golongan VIA, mampu menangkap 2 elektron
Natrium, merupakan unsur golongan IA, mampu mellepas 1 elektron
Klor, merupakan unsur golongan VIIA, mampu menangkap 1 elektron
Kalium, merupakan unsur golongan IA, mampu melepas 1 elektron
Kalsium, merupakan unsur golongan IIA, mampu melepas 2 elektron
Tabel Golongan dan cara mencapai kestabilan bisa dilihat disini:
Tentukan letak periode dan golongan suatu unsur dengan nomor atom berikut 1 k:19 2 s:16 3 Ni:28 4 PD:46 5 I:53
kalau sudah ada lambang unsurnya, bisa langsung cari di tabel periodik.
19K, golongan I-A perioda 3
16S, golongan VI-A perioda 3
46Pd, golongan VIII-B perioda 5
53I, golongan VII-A perioda 5
Unsur S, memiliki jumlah elektron 16, maka untuk mencapai kestabilan unsur tersebut harus?
Menangkap 2 elektron
cara menentukan elektron valensi dari (_7^14)N dan (_31^70)Ga dan konfigurasi elektronnya
Dibuat dulu konfigurasi elektron kulitnya:
7N : 2 - 5
31Ga : 2 - 8 - 18 - 3
maka:
elektron valensi N = 5
elektron valensi Ga = 3
Tentukan konfigurasi yang relatif lebih stabil! 24Cr diagram orbital dan kestabilannya 29Cu diagram orbital dan kestabilannya
| 24Cr | : |
|
| 29Cu | : |
|
Penyingkatan Konfigurasi Elektron 17Ci Ci− 16S S2−
17Cl-= [Ne] 3s2 3p6
16S2-= [Ne] 3s2 3p6
Terus Kembangkan Kemampuan Mu...ttp Semangan dalam mengerjakan soal dan memberikanx pd Kita.
terima kasih...
berapa elektron yang dapat dilepas atau diterima unsur-unsur berikut untuk mencapai kestabilan? O dengan nomor atom 8 dan AI dengan nomor atom 13
O dapat menangkap dua elektron menjadi ion O2-
Al dapat melepas tiga elektron menjadi ion Al3+
Jika unsur- unsurion yang berikut membentuk konfigurasi elektron stabil seperti unsur gas mulia, tentukan terbentuk ! 4 V
Buatlah ikatan ion dari : 19 K dengan 35 Br 20 Ca dengan 8 O 12 Mg dengan 17 Cl 13 Al dengan 16 S 56 Ba dengan 8 O
K+ + Br-
 KBr
KBr
Ca2+ + O2-
 CaO
CaO
Mg2+ + 2 Cl-
 MgCl2
MgCl2
2 Al3+ + 3 S2-
 Al2S3
Al2S3
Ba2+ + O2-
 BaO
BaO
Suatu unsur memiliki nomor atom 73, Maka periode dan golongan dari unsur tersebut adalah (diketahui gol 8A periode 1 = 2He ; 2 = 10Ne ; 3 = 18Ar ; 4 = 36Kr ; 5 = 54Xe ; 6 = 86Rn ; 7 = 118Uuo)
kita lihat saja tabel periodik
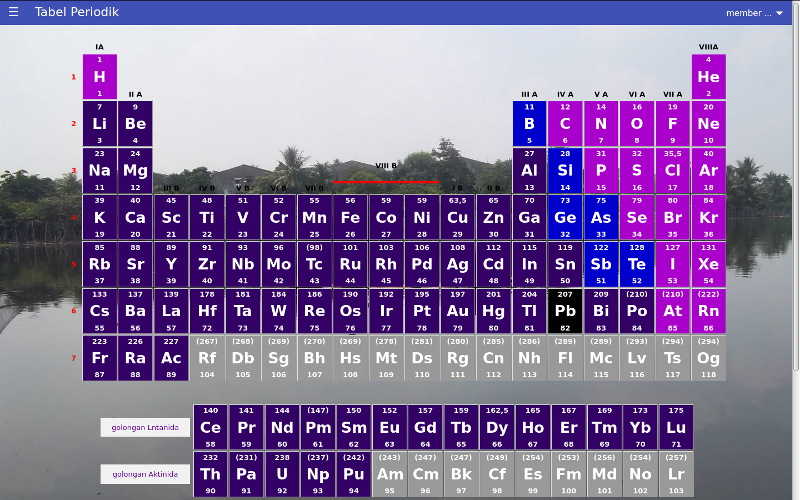
Nomor atom 73, terletak pada golongan VB periode 6.
Konfigurasi a. 8O B. 20Ca C. 36Kr
8O : 1s2 2s2 2p4
20Ca : [Ar] 4s2
36Kr : [Ar] 3d10 4s2 4p6
Konfigurasi elektron unsur-unsur bisa dilihat disini:
(Klik tombol unsur untuk melihat konfigurasi elektronya)
Trimakasih atas jawabannya 🙏
sama-sama
Jelaskan manakah yang lebih stabil antara atom K dengan atom Mg ditinjau dari konfigurasi elektron. Diketahui nomor atom K=19 dan nomor Mg=12.
atom Mg lebih stabil dibanding K, karena semua orbital Mg terisi penuh.
Semua atom memiliki nomoe atom 16. Konfigurasi electron atom tersebut adalah… a. 2 8 6 b. 2 6 8 c. 1 8 7 d. 2 9 5 e. 6 8 2
a. 2 - 8 - 6
Atom karbon mempunyai nomor atom 6 Jelaskan bagaimana cara atom karbon mencapai kestabilan?
Konfigurasi elektron:
6C : 2 - 4
Opsi untuk membentuk ion:
melepas 4 elektron
atau
menangkap 4 elektron
Karena jumlah elektron dalam opsi melepas dan menangkap sama besar (=4),
atom karbon ragu untuk membentuk ion, lebih suka membentuk ikatan kovalen.
Terimakasih banyak atas jawabannya
sama-sama
Unsur X yang bernomor atom 9 akan mencapai kestabilan dengan cara ....
Kita periksa dulu konfigurasi elektronnya.
9X : 2 -7
Karena elektron valensinya = 7, maka unsur X dapat mencapai kestabilan dengan menambah satu elektron menjadi ion X- (muatannya = -1).
Aluminium memiliki nomer atom 13, maka untuk mencapai kesetabilan Al akan
melepas 3 elektron menjadi ion Al3+.
Konfigurasi elektron untuk 13Al
13Al : 2 - 8 - 3
Konfigurasi elektron untuk 13Al3+
13Al3+ : 2 - 8
(sudah mirip dengan konfigurasi elektron unsur gas mulia, yaitu 10Ne)
Mengapa unsur dengan elektron valensi 1,2,3 cenderung melepas elektron untuk mencapai kestabilan?
Unsur mencari tindakan yang melibatkan elektron lebih sedikit.
Unsur ingin memiliki jumlah elektron pada kulit terluar sama seperti gas mulia (elektron=8).
| Elektron Valensi | Cara mencapai kestabilan |
| 1 | Memilih melepaskan 1 elektron dari pada menangkap 7 elektron (karena: 1 < 7) |
| 2 | Memilih melepaskan 2 elektron dari pada menangkap 6 elektron (karena: 2 < 6) |
| 3 | Memilih melepaskan 3 elektron dari pada menangkap 5 elektron (karena: 3 < 5) |
Kenapa golongan VIII A TIDAK ADA
konfigurasi elektron unsur-unsur golongan VIII-A sudah stabil
Buat lah unsur-unsur berikut menjadi stabil a. 6C c. 19K. e. 15AL b. 9F d. 16S
6C : 2 - 4, cenderung membentuk ikatan kovalen
9F : 2 - 7, akan menangkap 1 elektron (membentuk ion F-)
13Al : 2 - 8 - 3, akan melepas 3 elektron (membentuk ion Al3+)
16S : 2 - 8 - 6, akan menangkap 2 elektron (membentuk ion S2-)
19K : 2 - 8 - 8 - 1, akan melepas 1 elektron (membentuk ion K+)
Bagaimana unsur Na dan Cl mencapai kestabilan untuk membentuk 2NaCl
atom Na melepas 1 elektron menjadi ion Na+
atom Cl menangkap 1 elektron menjadi ion Cl-
Na+ dan Cl- bergabung membentuk senyawa NaCl
Na+ + Cl-  NaCl
NaCl
Bagaimana agar mencapai kestabilan dengan no atom 9 dan konfigurasi F adalah 2,7
Atom yang ber nomor atom 9 akan mencapai kestabilan dengan cara mengikat 1 elektron dan membentuk ion negatif F-
Ehmm... Ini sangat menarik, penjelasannya sangar mudah untuk dimengerti. Terimakasih, dan teruslah berkarya, ya! (^ω^)
terima kasih
Jelaskan cara atom B dan Cl Dalam mencapai kestabilannya
Karena sama-sama unsur nonlogam, B dan Cl berikatan kovalen membentuk BCl3.

Senyawa BCl3 merupakan salah satu senyawa yang tidak memenuhi kaidah oktet atau duplet. Atom B hanya mendapat 6 elektron valensi (bukan 8).
Beberapa senyawa lain yang tidak memenuhi kaidah duplet/oktet: PCl5, SF6, BF3, dll.
Bagaimana unsur 5N mencapai kestabilan
Ada dua cara unsur 5N mencapai kestabilan:
kan 3 cara atom untuk mencapai konfigurasi elektron yang stabil dan disini anda menulisnyh 2 cara ?
terima kasih masukannya.
saya akan coba untuk mendalaminya lagi.
iya, ada tiga ikatan yang bisa dibentuk antar atom untuk mencapai kestabilan: ikatan ionik, ikatan kovalen dan ikatan logam.
Saya tidak mencantumkan ikatan logam, karena menurut pemahaman saya, dalam ikatan logam (model lautan elektron yang bergerak bebas) tidak terbentuk konfigurasi elektron yang stabil seperti unsur-unsur gas mulia.
Maksudnya, dalam ikatan logam:
Ok saya pahaml
Tidak megerti
ok dan tak apa
Ap rumus molekul senyawa dari Al no atom 13 dan Cl atom 17
Al merupakan unsur logam sedangkan Cl unsur nonlogam.
Unsur logam dan unsur nonlogam dapat mencapai kestabilan dengan melakukan transfer elektron membentuk ikatan ionik.
13Al : 2 - 8 - 3, akan melepas 3 elektron (membentuk ion Al3+)
17Cl : 2 - 8 - 7, akan menangkap 1 elektron (membentuk ion Cl-)
Karena setiap atom Cl hanya mampu menangkap 1 elektron, maka dibutuhkan 3 atom Cl untuk menangkap 3 elektron yang dilepaskan oleh Al.
Maka rumus molekul dari persenyawaan Al dan Cl adalah: AlCl3
Al3+ + 3 Cl-  AlCl3
AlCl3
Unsur Nonlogam,Atom Cl,Ion- Bagaimana cara unsur unsur tersebut mencapai kestabilan?
Ada dua cara unsur nonlogam mencapai kestabilan.
1tambah 1 hasilnya berapa
lebih dari 7,7 miliar
Apa akibatnya setelah atom mempunyai susunan elektron yang stabil
stabil bisa diartikan sebagai kondisi yang "nyaman" bagi suatu atom.
atom akan "mudah" berubah ke bentuk/spesi yang lebih stabil .
spesi yang sudah stabil akan sulit untuk kembali ke kadaan yang tidak stabil (membutuhkan energi yang besar).
Misalnya: logam Na (spesi yang tidak stabil) akan mudah berubah menjadi ion Na+ (spesi yang stabil) bila bertemu dengan air.
Na (s) + H2O (l)  Na+ (aq)
Na+ (aq)
Reaksi akan berlangsung spontan (langsung terjadi ketika logam Na terkena air).
Tetapi untuk mengubah Na+ menjadi Na, diperlukan perlakuan khusus (dan membutuhkan energi), misalnya dengan proses elektrolisis (dalam prakteknya dibutuhkan energi listrik).
Unsur Na yang ada disekitar kita umumnya berada dalam bentuk/spesi Na+. Misalnya dalam NaCl, NaOH, Na2SO4, dll.
Saya sangat terbantu sekali. Thaks😇
yw
Unsur X memiliki no atom 18 bagaimana unsur X mencapai kestabilan?
karena elektron valensinya sudah 8, jadi unsur x sudah stabil
betul
Bagaimana hubungan antara lewis dengan kestabilan suatu unsur??
Struktur lewis menggambarkan keadaan elektron valensi disekitar atom.
Dengan menggambarkan struktur Lewis, kita dapat menjelaskan apakah keadaan elektron valensinya sudah sama dengan unsur gas mulia (stabil) atau belum.
Bagaimana agar 11Na dan 8O agar mencapai kestabilan?
Na (unsur golongan IA), membentuk ion Na+.
O (unsur golongan VIA), membentuk ion O2-.
Kestabilan akan tercapai jika dua ion Na+ berikatan ionik dengan satu ion O2- membentuk senyawa Na2O.
Persamaan reaksinya sebagai berikut:
 Na2O
Na2O
Makasi
sama-sama
👍👍👍
Rumus lewis,bangun,dan rumus molekul??


Terimakasih ini sangat membantu saya😁😁☺
sama-sama
Atom manakah yang melepaskan elekron
Atom yang energi ionisasinya kecil, akan lebih mudah melepas elektron.
Dalam tabel periodik, unsur-unsuryang memiliki energi ionisasi kecil biasanya ada di sebelah kiri.
Syokron Katsiran
ok
Saya merasa puas
siip
Dengan cara apakah unsur Ca dam unsur Cl dapat mencapai kestabilan seperti pada unsur gas mulia
Jika Ca dan Cl membentuk ikatan ionik, maka:
Ca melepas 2 elektron, menjadi ion Ca2+
Cl melepas 1 elektron, menjadi ion Cl-.
Jadi kalau unsur golongan IV A supaya stabil bagaimana ka?
golongan VIIIA cenderung berikatan kovalen
(penggunaan bersama pasangan elektron)
Cara menstabilkan unsur 36A , 2B 19C
Diketahui unsur 4BE, 11NA, 19K bagaimana cara agar atom unsur unsur tersebut mencapai kestabilannya?
4Be : 2 2 11Na : 2 8 1 Melepas 1 e 19K : 2 8 8 1 Melepas 1 e
Yg Be melepas 2e
Siip..
Unsur kalsium memiliki nomor atom 20. Agar tercapai kestabilan ,maka unsur tersebut.
Konfigurasi elektron 20Ca : 2 - 8 - 8 - 2
Karena elektron valensinya = 2, maka kalsium (Ca) mencapai kestabilan dengan melepas 2 elektron, membentuk ion Ca2+.
Mantap mbak/mas terima kasih banyak
sama-sama
Bagaimana unsur Li mencapai kestabilan?
Li mencapai kestabilan dengan melepas 1 elektron, sehingga menjadi ion Li+
Li merupakan unsur yang berada dalam golongan I-A.
Semua unsur golongan I-A mencapai kestabilan dengan melepas 1 elektron, menghasilkan ion bermuatan +1.
Bagaimana unsur 9f mencapai kestabilan ?
Untuk mencapai kestabilan, F akan menangkap 1 elektron sehingga menjadi ion F-.
Konfigurasi elektron 9F : 2 - 7.
Semua unsur dengan elektron valensi (terakhir) = 7 (golongan VII-A), mencapai kestabilan dengan menambah 1 elektron sehingga menjadi ion dengan muatan -1.
Maksud saya bagaimana cara mencapai kestabilan unsur dengan menggunakan peta kestabilan?
apakah maksudnya pita ketsabilan unsur?
Maksud saya sebutka 3 cara yang dapat dilakukan oleh atom suatu unsur untuk mencapai konfigurasi elektron yang stabil seperti konfigurasi elektron gas mulia..mkasi kaak
Cara mencapai kestabilan (memiliki konfigurasi elektron seperti gas mulia):
Maksud saya atom unsur di bawah ini yg akan melepaskan sebuah elektron untuk mencapai kestabilan adalah ..... Apakah: A. 13 Al B. 20 Ca C. 17 Cl D. 16 S E. 19 K apa jawabannya
| Unsur | Konfigurasi elektron | Cara mencapai kestabilan | ion yang terbentuk | |
|---|---|---|---|---|
| A. | 13Al | 2 - 8 - 3 | melepas 3 elektron | Al3+ |
| B. | 20Ca | 2 - 8 - 8 - 2 | melepas 2 elektron | Ca2+ |
| C. | 17Cl | 2 - 8 - 7 | menangkap 1 elektron | Cl- |
| D. | 16S | 2 - 8 - 6 | menangkap 2 elektron | S2- |
| E. | 19K | 2 - 8 - 8 - 1 | melepas 1 elektron | K+ |
Kurang jelas
Ok. Trims masukannya. Coba nanti materinya kami kaji lagi
 www.lagonlon.com
www.lagonlon.com
|